尿石素 A (UA:Urolithin A )直接靶向线粒体自噬的科学证据:
临床前动物研究
越来越多的证据支持尿石素 A 与其刺激线粒体自噬能力之间的联系。例如,Luan 等人 (2021) 的一项研究调查了尿石素 A 作为杜氏肌营养不良症 (DMD) 治疗方法的潜力,杜氏肌营养不良症是一种主要影响男孩的严重遗传性疾病。由于肌营养不良蛋白基因突变,DMD 会导致肌肉进行性无力和退化,而肌营养不良蛋白基因对于维持肌肉细胞结构和功能至关重要。肌营养不良蛋白是一种稳定蛋白,将肌肉细胞膜与细胞外基质连接起来,使肌肉能够承受反复收缩。如果没有肌营养不良蛋白,肌肉细胞就会变得脆弱,随着时间的推移而变弱,并逐渐恶化。
DMD 面临的一个关键挑战是线粒体功能障碍,这极大地促进了疾病的进展。受 DMD 影响的肌肉细胞中的线粒体表现出功能下降、能量产生减少和氧化应激增加。此外,研究表明,参与线粒体自噬的基因在 DMD 中通常表达不足,从而降低了肌肉细胞有效清除受损线粒体的能力。对 DMD 小鼠模型的研究一直表明线粒体自噬标志物水平下降,表明在这种疾病背景下线粒体自噬受损。 [ 2 ]
本研究的研究人员探索了尿石素 A 是否能激活线粒体自噬过程来解决这个问题。他们测试了尿石素 A 对小鼠和人类肌肉细胞的影响。在小鼠的食物中添加尿石素 A,剂量为每天每公斤 50 毫克。在人体试验中,从三名健康男孩和三名患有 DMD 的男孩身上获取肌肉细胞,他们的年龄均为 4 至 7 岁。这些细胞用 25 μM 尿石素 A 处理不同时间(2、6 和 24 小时)。研究发现,尿石素 A 增强了小鼠和受 DMD 影响的人类肌肉细胞中缺陷线粒体的清除。这种改善使线粒体功能更好,并提高了肌肉利用氧气的能力,这表明尿石素 A 可能通过促进线粒体自噬来减轻 DMD 症状。[ 2 ]
Huang 等人 (2023) 最近在著名期刊《自然》上发表了一项名为《尿石素 A 通过激活线粒体自噬改善小鼠肥胖诱发的代谢性心肌病》的研究,探讨了尿石素 A 在管理代谢性心肌病 (MC) 中的作用,这种疾病通常与肥胖有关。MC 的特征是心脏细胞内脂肪堆积,这会破坏正常的心脏功能并导致氧化应激和线粒体功能障碍。这种疾病尤其令人担忧,因为它会损害心脏的能量产生、削弱收缩力,并且缺乏有效的治疗选择。
在肥胖病例中,心肌细胞表现出明显的线粒体异常。这些细胞中的线粒体通常表现出呼吸受损、细胞内错误定位和线粒体自噬紊乱——这是线粒体质量控制的关键过程。线粒体经历不断的动态循环,包括裂变(分裂)、融合(连接)、生物合成(产生新的线粒体)和线粒体自噬(选择性降解)。在这些过程中,线粒体自噬通过清除受损或老化的线粒体,从而防止可能损害细胞健康的功能失调细胞器的积累,在维持线粒体稳态方面发挥着关键作用。
在健康细胞中,线粒体自噬由 PINK1/Parkin 或受体依赖性通路等途径促进,这两者都以受损的线粒体为目标,进行降解和循环利用。然而,在 MC 小鼠的心肌细胞中,研究人员观察到线粒体增大,膜电位塌陷,表明存在严重功能障碍。这些线粒体无法维持必要的能量梯度,无法被有效清除,这表明受损的线粒体自噬是导致这种情况的原因。受损线粒体的积累可能会加剧氧化应激并进一步削弱线粒体功能。[ 3 ]
在这项研究中,Huang 等人试图确定线粒体自噬功能不佳是否是 MC 的驱动因素,以及 Urolithin A 是否可以减轻这些影响。他们使用肥胖诱发的小鼠 MC 模型,给小鼠喂食高脂肪饮食 20 周以诱发肥胖和 MC 症状,然后以每天每公斤 50 毫克的剂量进行为期 4 周的 Urolithin A 治疗。目的是评估 Urolithin A 是否可以恢复线粒体自噬,从而减少线粒体功能障碍并改善心脏健康。[ 3 ]
研究人员发现肥胖与心脏细胞线粒体自噬减少之间存在密切联系。在接受尿石素 A 治疗的小鼠中,线粒体自噬活性显著改善,MC 症状减轻。当心脏细胞暴露于棕榈酸(一种脂肪)时,5 μM 尿石素 A 会增加自噬体(吞噬受损线粒体)的产生,同时减少自噬溶酶体(分解自噬体)。尿石素 A 有助于平衡这些过程,从而更好地清洁线粒体。此外,当使用线粒体自噬阻滞剂或基因沉默技术来抑制 Parkin(线粒体自噬中的关键蛋白质)时,尿石素 A 的保护作用会降低,进一步证明尿石素 A 的益处与恢复线粒体自噬有关。[ 3 ]
这些动物研究表明,尿石素 A 可增强线粒体自噬,通过促进线粒体功能和减缓疾病进展来改善杜氏肌营养不良症和代谢性心肌病等病症。
临床研究
除了临床前动物研究外,尿石素 A 的研究已扩展到人体试验。Singh 等人 (2022) 的一项研究题为《尿石素在中年成人随机试验中改善肌肉力量、运动表现和线粒体健康的生物标志物》,调查了尿石素 A 在四个月内对中年成人线粒体自噬的影响。[ 4 ]
研究设计
该研究旨在确定最有效的功能性结果,特别是与肌肉力量、运动耐力和整体身体表现相关的指标。目标是确定可以指导未来涉及 UA 的验证性临床试验的设计和功效计算的结果。
研究对象包括 88 名年龄在 40 至 64 岁之间、未受过训练的成年人,他们超重且身体耐力低下,定义为最大耗氧量 (VO2max) 低于 35 mL/kg/min。参与者是根据纳入和排除标准从 253 名个体中初步筛选出来的,这些标准要求受试者健康,根据其生命体征、人体测量指标和无慢性疾病来判断。参与者被随机分为三组:500 毫克 UA 组、1,000 毫克 UA 组和安慰剂组。根据肌肉功能临床试验专家组的指导方针,干预持续 4 个月,这是预计能揭示对身体表现和肌肉功能影响的最短持续时间。
ATLAS 研究是一项双盲、安慰剂对照试验,各组受试者的基线特征匹配良好。500 毫克 UA、1,000 毫克 UA 和安慰剂组的受试者平均年龄(约 51-54 岁)、BMI(约 29 千克/平方米)和基线耐力(最大摄氧量约 23 毫升/千克/分钟)相似。研究队列中的女性受试者比例较高(男女比例为 2:1),主要为西欧人种。
在整个研究过程中,研究人员收集了血浆样本,以评估 UA 对与细胞健康相关的代谢物和细胞因子的影响,同时进行了骨骼肌活检,以评估 UA 对肌肉转录组和蛋白质组的影响,特别关注与线粒体健康和细胞能量通路相关的蛋白质。这种综合方法旨在深入了解 UA 对细胞健康指标、肌肉功能和整体身体表现的影响潜力。
结果
研究表明,服用 Urolithin A 的参与者表现出线粒体自噬增强,肌肉力量(约 12%)和有氧耐力显著提高。通过等速 Biodex 测力计测试测量,服用 500 毫克和 1,000 毫克 UA 的参与者的腿筋肌肉力量显著增加。两组的腿筋肌肉平均峰值扭矩均显著增加,与安慰剂相比,500 毫克组增加 12%(p = 0.027),1,000 毫克组增加 9.8%(p = 0.029)。两组 UA 组膝关节屈曲期间的最大扭矩也显著改善,与安慰剂相比,500 毫克组增加 10.6%(p = 0.017),1,000 毫克组增加 10.5%(p = 0.022)。
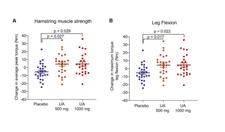
有氧耐力是通过峰值耗氧量 (VO₂) 来衡量的,它表明身体在运动过程中利用氧气的效率,以及 6 分钟步行测试 (6MWT),这是一种简单的身体耐力测量方法。[ 4 ]
PPO 是本研究的主要预设终点。尽管 UA 补充组和安慰剂组之间没有观察到显著差异,但两个 UA 组的 PPO 均较基线增加约 4%,但幅度不大,表明功率输出有改善的趋势。相比之下,安慰剂组的 PPO 没有变化,表明 UA 补充可能有助于运动表现的小幅提升,但需要进一步研究以确认统计意义。
1,000 毫克 UA 组参与者的总骑行距离从基线到研究结束增加了 15% (p = 0.03),同时运动测试期间疲劳时间也显著增加。这一发现表明,高剂量 UA 可能有助于提高耐力,使参与者在疲劳前可以骑行更远,并维持更长时间的活动。
UA 1,000 mg 剂量组的峰值 VO₂ 和估计 VO₂max 在 2 个月中点和 4 个月终点均表现出显著的组内增加(p < 0.01),表明有氧耐力有明显改善。虽然与安慰剂相比,这些变化在统计学上并不显著,但它们显示出有利于 UA 干预的强烈趋势(p = 0.058),尤其是在 1,000 mg 剂量组。
有趣的是,在 1,000 毫克 UA 组中未观察到酰基肉碱水平的显著变化。这种没有变化表明酰基肉碱的下调可能与剂量或持续时间有关,较低剂量可能提供影响该特定生物标志物的最佳 UA 水平。在 500 毫克组中观察到的降低也可能反映了随时间出现的反应,可能需要平衡剂量才能影响某些血浆生物标志物。
随后,该研究分析了对炎症和线粒体功能的总体影响。为了确定补充 UA 后观察到的肌肉功能改善是否也反映在代谢健康的替代血浆生物标志物中,研究人员分析了参与者血浆中的酰基肉碱水平。酰基肉碱是参与脂肪酸代谢的脂质分子,酰基肉碱水平的降低,特别是在中链和长链物种中,通常与脂肪酸氧化和代谢效率的增强有关。
在 UA 500 毫克组中,血浆酰基肉碱水平降低,中链和长链酰基肉碱的降低最为显著。这种下调表明脂肪酸氧化有所改善,因为循环中酰基肉碱水平较低表明脂肪酸在细胞内被更有效地分解并用作能量。这一发现与先前的临床研究一致,这些研究将酰基肉碱的减少与线粒体功能和代谢健康的改善联系起来

除了线粒体效率外,该研究还分析了炎症标志物。炎症是衰老和代谢功能障碍的关键因素,因此成为评估 UA 补充剂更广泛益处的关键重点领域。这项研究评估了血浆中 C 反应蛋白 (CRP) 和几种促炎细胞因子的水平,以确定 UA 对肌肉功能和线粒体健康的影响是否伴有全身抗炎益处。
CRP 是系统性炎症的明确生物标志物,也是与年龄相关的慢性疾病的预测指标。超重人群中 CRP 水平升高很常见,并且与较高的 BMI 密切相关。在基线时,中年超重参与者的平均 CRP 浓度约为 3 mg/L,使他们处于慢性疾病的中度至高度风险类别。
两种剂量的 UA 补充剂均降低了血浆 CRP 水平,其中 1,000 毫克组的降低达到统计学显著水平。这表明较高剂量的 UA 可能有效降低全身炎症,从而可能减轻与慢性炎症状态相关的风险。

除了 CRP 之外,补充 UA 还可降低关键促炎细胞因子,包括干扰素γ (IFN-γ)、白细胞介素 1β (IL-1β) 和肿瘤坏死因子 α (TNF-α)。这些细胞因子是炎症过程的主要介质,在慢性炎症和与年龄相关的疾病中通常会升高。尽管本研究人群的基线细胞因子水平相对较低,但在补充 UA 后观察到细胞因子水平降低,表明具有轻微的全身抗炎作用。
CRP 的下降表明尿石素 A 也有助于减少全身炎症,这可能是因为它增强了骨骼肌中的线粒体自噬和线粒体代谢。 [ 4 ]
这些发现表明,尿石素 A 有助于改善中年人的线粒体功能、提高有氧能力并减少炎症,使其成为一种对抗肌肉随年龄下降的有希望的干预措施。
D'Amico 等人 (2022) 进行的另一项研究名为《尿石素 A 改善线粒体健康、减少软骨退化并缓解骨关节炎疼痛》,探讨了尿石素 A 在治疗骨关节炎 (OA) 方面的潜力,骨关节炎是一种常见的关节疾病,目前尚无有效疗法。OA 影响全球约 5 亿人,导致软骨退化、疼痛和活动能力受损。已知线粒体功能障碍会导致 OA 进展。该研究检查了尿石素 A 对健康捐赠者和 OA 患者的人类膝关节细胞的影响,结果显示尿石素 A 改善了关节细胞中的线粒体自噬和线粒体呼吸。[ 5 ]
在 OA 小鼠模型中,尿石素 A 通过减少软骨退化、滑膜炎症和疼痛来减缓疾病进展。此外,OA 小鼠关节中线粒体自噬和线粒体含量增加与疾病进展减缓相关,这表明尿石素 A 增强线粒体自噬的能力可能在 OA 管理中提供治疗益处。[ 5 ]
动物和人类研究的集体结果强调了 Urolithin A 在促进线粒体自噬和改善线粒体健康方面的治疗潜力。在 Singh 等人 (2022) 和 D'Amico 等人 (2022) 等研究中,Urolithin A 增强了线粒体自噬,改善了肌肉健康和有氧耐力,甚至有助于减少骨关节炎的炎症和关节退化。这些研究表明,Urolithin A 有望成为一种治疗干预手段,通过针对线粒体功能障碍来管理与年龄相关的疾病,如肌肉衰退和关节疾病。